Der britische Arzt und Autor Ben Goldacre seziert den Pharmamarkt: Daten würden versteckt, Ärzte in die Irre geleitet. Mit seiner Kritik ist er nicht allein. Auch bei der Zulassung von Medizinprodukten scheint nicht alles perfekt zu laufen.
Stuttgart - Obwohl das Thema nicht lustig ist, weil Menschenleben auf dem Spiel stehen, kann sich Ben Goldacre die Aufforderung „Enjoy“, genießen Sie es, im Vorwort nicht verkneifen. Und es stimmt ja: Wohl kaum jemand schreibt gegenwärtig so lebendig, so spannend und so fundiert über den Wissenschaftsbetrieb wie der 38-jährige Kolumnist der britischen Zeitung „Guardian“. Das vor vier Jahren erschienene Erstlingswerk „Bad Science“ wurde in seiner Heimat ein Sachbuch-Bestseller und in 24 Sprachen übersetzt. 2010 kam es mit dem Titel „Die Wissenschaftslüge“ auch auf den hiesigen Markt. Sein zweites Werk, das bisher nur in englischer Sprache vorliegt, wird wohl den gleichen Weg nehmen. Während sich „Bad Science“ mit einem Themenpotpourri zu Hirngymnastik, Homöopathie und Ähnlichem zufrieden gab, bohrt das neue Buch nun unerbittlich in den Tiefen des Pillengeschäfts.
Der Arzneimittelmarkt sei kaputt, das ist Goldacres Kernthese. Denn Medikamente würden von den Firmen getestet, die sie herstellen – in mageren Studien mit zu geringen Teilnehmerzahlen. Der Nutzen werde übertrieben dargestellt, das Risiko unter den Teppich gekehrt. Unabhängige Forscher könnten die Daten oft nicht überprüfen, weil die Zulassungsstellen sie nicht herausgäben. Goldacre räumt zwar ein: „Medizinhersteller auf der ganzen Welt haben einige der erstaunlichsten Erfindungen in den vergangenen 50 Jahren produziert, mit deren Hilfe zahllose Leben gerettet wurden.“ Doch das erlaube ihnen nicht, „Daten zu verstecken, Ärzte in die Irre zu leiten und Patienten zu gefährden“.
Unerwünschte Daten fallen unter den Tisch
2008 haben Forscher zum Beispiel versucht, sich einen Überblick über alle Publikationen zur Wirkung von Antidepressiva zu verschaffen, die zwischen 1987 und 2004 bei der US-Gesundheitsbehörde FDA gemeldet worden waren. Dabei stießen sie für zwölf Medikamente verschiedener Hersteller auf 74 Studien an insgesamt 12.500 Patienten. 38 dieser Studien attestierten dem jeweiligen Medikament eine Wirkung, bei den 36 anderen Studien war das Ergebnis negativ.
Doch während fast alle der positiven Studien in vollem Umfang veröffentlicht worden waren, fanden von den 36 negativen Studien nur drei den Weg in die Öffentlichkeit. 22 verstaubten in den FDA-Archiven, und elf tauchten zwar in der Fachliteratur auf, waren aber so formuliert, als ob das Medikament doch erfolgreich sei.
Solche verzerrten Darstellungen seien keine Einzelfälle, sondern Normalität, schreibt Goldacre. Ärzten werde es dadurch unmöglich gemacht, angemessene Verschreibungen zu tätigen – erst recht, weil Pharmafirmen auch einen Großteil ihrer Fortbildungen sponsern. „Wir alle wissen, dass da etwas schiefläuft, aber geändert hat sich trotzdem so gut wie nichts in den letzten Jahren.“ Man dürfe allerdings den Schwarzen Peter nicht allein der Pharmabranche zuschieben, räumt der Autor ein. Schließlich handle es sich nicht um einen Wohltätigkeitsbetrieb, sondern die Firmen „existieren, um Medikamente zu verkaufen und ihren Aktionären Gewinn zu verschaffen“. Umso wichtiger sei aber strenge Regulierung von außen. An der fehle es allzu oft.
Steht die Behörde nicht auf der Seite der Patienten?
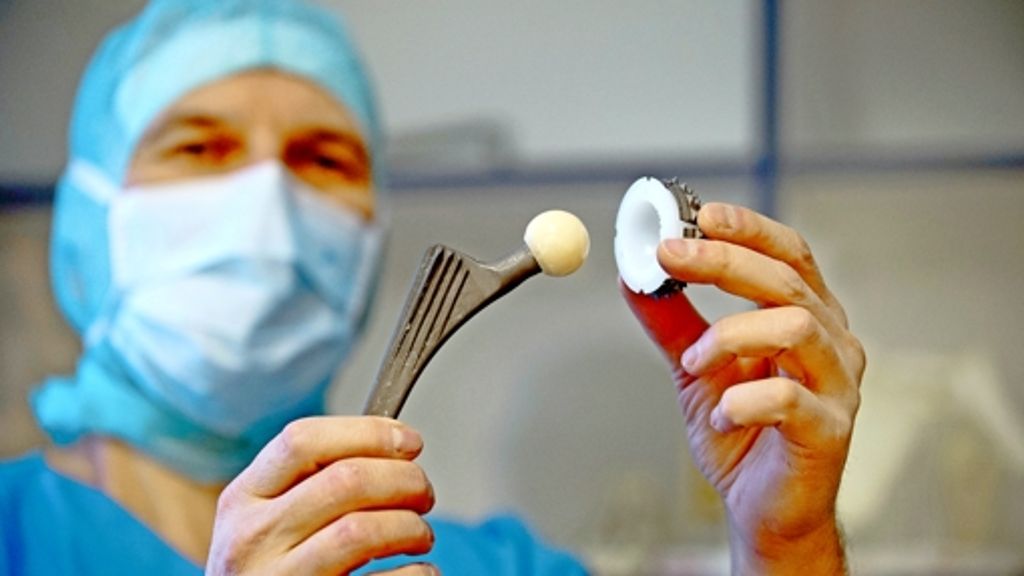
Dass dies nicht nur für den Markt der Medikamente, sondern auch für den Markt der Medizinprodukte gilt, haben kürzlich Journalisten der Zeitung „Daily Telegraph“ gemeinsam mit Kollegen des Mediziner-Fachblatts „British Medical Journal“ ans Licht gebracht. In einer mehrmonatigen Recherche zeigten sie, dass es für zwielichtige Hersteller ein Kinderspiel ist, minderwertige und sogar schadhafte Produkte auf den europäischen Markt zu bringen. Die Journalisten gaben sich als Hersteller aus, die die Zulassung für ein künstliches Hüftgelenk beantragen wollten.
Dass es das Produkt gar nicht gab und dass es laut der eingereichten Unterlagen zudem noch schädlich war, weil es giftige Stoffe absonderte, interessierte die Zulassungsstellen offenbar nicht. Man sei auf Seite der Hersteller, nicht der Patienten, sagte der Mitarbeiter einer tschechischen Zertifizierungsstelle. Rund 80 solcher sogenannten „Benannten Stellen“ in Europa verleihen das begehrte CE-Kennzeichen. Damit ist das Medizinprodukt auf dem europäischen Markt zugelassen.
Im vergangenen Jahr wurden Reporter des britischen Senders BBC ähnlich fündig, als sie den Wegen nachspürten, auf denen fehlerhaftes OP-Besteck aus Fernost in britische, deutsche und amerikanische Kliniken gelangt. 100 Millionen OP-Instrumente jährlich werden im pakistanischen Sialkot hergestellt. Zu 70 Prozent seien die Hersteller zwar in England registriert, produziert werde aber in Pakistan, und das nicht selten unter katastrophalen hygienischen Hinterhofbedingungen, erfuhren die BBC-Journalisten. Um die Instrumente in Europa zu verkaufen, brauchen auch die pakistanischen Produzenten das begehrte CE-Zeichen. Da Standards in Tschechien oder Rumänien aber nicht mit denen in Deutschland oder England vergleichbar sind, sei die Herstellung von Medizinprodukten praktisch „eine Lizenz zum Gelddrucken“ geworden, sagte ein deutscher Aufsichtsbeamter, der damals lieber anonym bleiben wollte. Wenn das einmal zugelassene Produkt nach Deutschland kommt, wird es – von wenigen Stichproben der hiesigen Gewerbeaufsichtsämter abgesehen – nicht mehr kontrolliert.
Die neuen Regelungen der EU lösen keine Freude aus
Dabei kann fehlerhaftes OP-Besteck winzige Löcher in OP-Handschuhe reißen oder mittels unerwünschter Rillen Körperflüssigkeiten transportieren und auf diese Weise zur Verbreitung der multiresistenten Klinikkeime beitragen. Wenn auf diese Weise ein Patient erkrankt, sieht dies dann nach einem Behandlungsfehler des Arztes und nicht nach einem Produktionsfehler des Herstellers aus. Eine Verschärfung der Kontrollen sei zwar dringend erforderlich, aber „politisch nicht gewollt“, sagte jener deutsche Aufsichtsbeamte.
Zwar hat die Europäische Union erst im September eine Neuregelung für Medizinprodukte vorgelegt. Jürgen Windeler, der Leiter des Instituts für Qualität und Wirtschaft im Gesundheitswesen, ist jedoch nicht überzeugt. Laut Medienberichten sieht er in der Neuregelung keine relevanten Veränderungen. Goldacre dürfte das freuen: Nach dem Pharma-Sumpf könnte er sich als Nächstes dem Medizinprodukte-Wildwuchs widmen. Ein solches Buch zu schreiben und zu lesen würde sich sicher ganz genauso lohnen.
Wie die Zulassung in Europa funktioniert
Medizinprodukte
Sind etwa Hüftprothesen in einem EU-Land erst einmal zugelassen, dann sind sie auch in allen anderen EU-Staaten verkehrsfähig. Ein europaweit einheitliches Zulassungsverfahren gibt es nicht. Für die Zulassung reicht es, wenn der Hersteller sein Produkt bei einer „Benannten Stelle“ vorstellt und anmeldet. Die Behörden beschränken sich danach auf Stichprobenkontrollen, Registrierung und jährliche Zertifizierung der Benannten Stellen. Kritiker beklagen, Nutzen und therapeutische Wirksamkeit spielen für die Medizinproduktzulassung keine Rolle.
Arzneimittel
Der Hersteller in einem Dossier begründen, dass das neue Medikament therapeutisch wirksam ist und sein Nutzen das Risiko übersteigt. Die Behörde prüft dies. Ändert sich die Erkenntnis oder Einschätzung, muss die Arznei sofort vom Markt genommen werden.